شهد مجال علاج الأورام تطوراً ملحوظاً مع ظهور تقنيات إشعاعية حديثة تهدف إلى زيادة فعالية العلاج وتقليل آثاره الجانبية. من بين أبرز هذه التقنيات هي العلاج بالبروتون، التي بفضل خصائصها الفيزيائية الفريدة، تسمح بإيصال جرعة عالية من الإشعاع مباشرة إلى الورم مع حماية الأنسجة السليمة. هذا الأسلوب أصبح خياراً متزايد الاعتماد في علاج بعض أنواع السرطانات الدقيقة والمعقدة.
ما هو العلاج بالبروتون؟
العلاج بالبروتون أو ما يُعرف أيضاً بالعلاج الشعاعي بحزمة البروتون، هو أحد أشكال العلاج الإشعاعي الحديث الذي يعتمد على استخدام جسيمات مشحونة موجبة (البروتونات) لاستهداف الخلايا الورمية بدقة عالية.
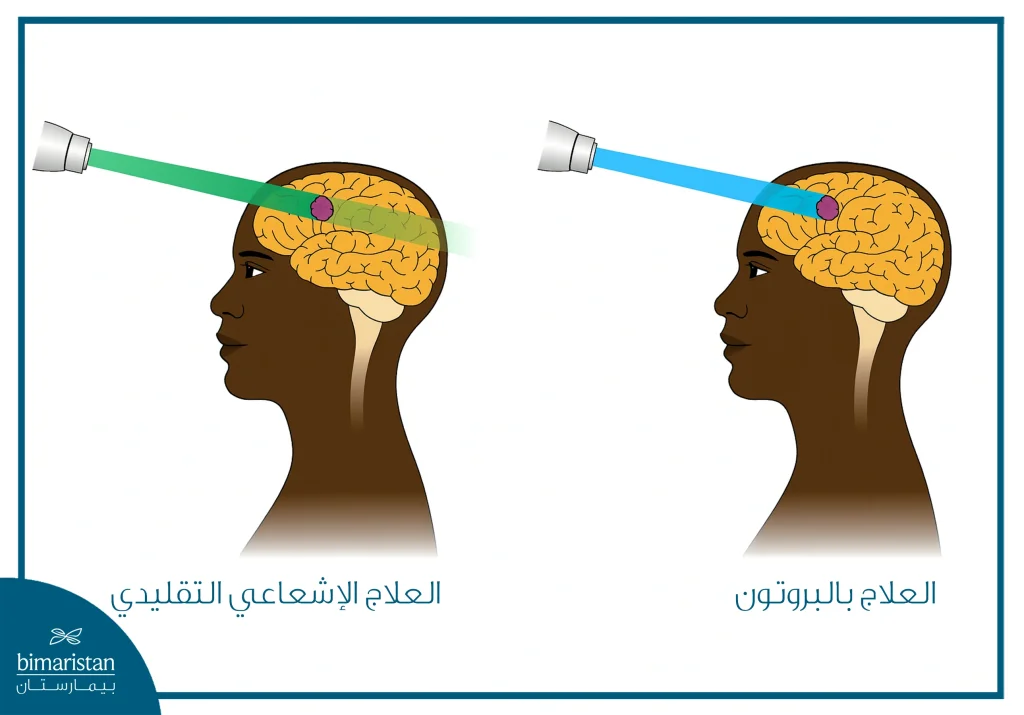
يختلف هذا الأسلوب عن العلاج التقليدي بالأشعة السينية (الفوتونات) في أن البروتونات تُطلق معظم طاقتها عند نقطة محددة داخل الورم تُعرف باسم ذروة بريغ، مما يسمح بإيصال الجرعة العلاجية إلى الورم بشكل مركّز مع تقليل الجرعة الواصلة إلى الأنسجة السليمة المحيطة. هذه الخاصية تمنح العلاج بالبروتون ميزة واضحة في تقليل المضاعفات الجانبية، خاصةً عند معالجة الأورام القريبة من الأعضاء الحساسة أو لدى الأطفال.
ما هي آلية عمل العلاج بالبروتون؟
يقوم العلاج بالبروتون على تسريع جسيمات صغيرة تُسمى البروتونات إلى سرعات عالية جداً، ثم توجيهها بدقة نحو الورم باستخدام مسرّعات خاصة مثل السينكروترون أو السيكلوترون. عند دخول البروتون إلى الجسم يطلق جزءاً بسيطاً من طاقته أولاً، ثم يتركز معظم تأثيره عند نقطة محددة داخل الورم تُعرف بذروة بريغ، وبعدها يتوقف عن التقدم فلا يسبب ضرراً إضافياً للأنسجة بعد الورم. هذه الخاصية تسمح بإيصال جرعة مركزة من الإشعاع إلى الخلايا السرطانية مع حماية الأنسجة السليمة المحيطة.
يُوجه الشعاع بواسطة جهاز ضخم يسمى الغانتري قادر على الدوران بزاوية 360 درجة حول المريض، ويتم التحكم به عبر مغناطيسات قوية تعمل على تركيز الحزمة في شعاع رفيع لا يتجاوز 5 ملم. يمكن تعديل طاقة البروتونات بحيث تصل الجرعة بدقة إلى العمق المطلوب، بل ويمكن توزيع جرعات مختلفة على أجزاء مختلفة من الورم، ويعمل الإشعاع البروتوني على إتلاف الحمض النووي (DNA) داخل الخلايا السرطانية، مما يؤدي إلى فقدان قدرتها على الانقسام والإصلاح، وبالتالي يتوقف نمو الورم تدريجياً ويبدأ في الانكماش، وتعتمد فعالية العلاج على حجم الورم، وموقعه، وطبيعة الخلايا المصابة.
من هم المرشحون للعلاج بالبروتون؟
يُعد العلاج بالبروتون خياراً متقدماً لعلاج مجموعة واسعة من الأورام، سواء كان علاجاً وحيداً أو جزءاً من خطة علاجية متكاملة إلى جانب الجراحة أو العلاج الكيماوي. كما يمكن الاستفادة منه في حال لم يستجب الورم للعلاج الإشعاعي التقليدي أو عند عودة المرض بعد فترة من العلاج، ويُستخدم هذا النوع من العلاج بشكل خاص عند التعامل مع الأورام التي تتطلب دقة عالية لحماية الأنسجة السليمة القريبة من الورم، مثل:
- سرطانات الرأس والعنق
- أورام العمود الفقري والعظام
- أورام الدماغ وقاعدة الجمجمة
- سرطانات الثدي والمريء والرئة
- أورام العين، ومنها الميلانوما العينية
- سرطانات الكبد والبنكرياس والبروستاتا والمستقيم
- الأورام اللمفاوية وأورام النسيج الضام مثل الساركوما
- الحالات التي تحتاج إلى إعادة العلاج الإشعاعي بعد الانتكاس
- الأورام لدى الأطفال، لتقليل المضاعفات طويلة الأمد الناتجة عن الإشعاع
ما تزال الدراسات السريرية جارية لتقييم فعالية العلاج بالبروتون في أنواع أخرى من الأورام، الأمر الذي يعزز مكانته كأحد أكثر الأساليب الواعدة في علاج السرطان.
أنواع العلاج بالبروتون
تطورت تقنيات العلاج بالبروتون على مر السنوات لتصبح أكثر دقة وأماناً، ويمكن تقسيمها إلى نوعين رئيسيين:
- العلاج بالتبعثر السلبي: في هذه الطريقة يُوزع شعاع البروتون باستخدام أدوات ميكانيكية مثل المرشحات والأقنعة ليغطي كامل حجم الورم. تتميز ببساطتها واعتمادها منذ بدايات العلاج بالبروتون، لكنها أقل قدرة على مطابقة الشكل الدقيق للورم، مما قد يؤدي إلى تعرض بعض الأنسجة السليمة لكمية بسيطة من الإشعاع.
- العلاج بالمسح بالقلم: وهي التقنية الأحدث والأكثر تقدماً، حيث يُوجَّه شعاع رفيع جداً من البروتونات “كالقلم” لرسم الجرعة داخل الورم طبقة بعد طبقة. تسمح هذه التقنية بتوزيع الإشعاع بدقة عالية تتوافق مع شكل الورم ثلاثي الأبعاد، وتقلل بشكل كبير من تعرض الأعضاء المجاورة للأذى، ولهذا أصبحت هي التقنية الأكثر اعتماداً في المراكز الحديثة.
بفضل هذا التطور من الأسلوب التقليدي إلى الأسلوب الموجَّه بالقلم، أصبح بالإمكان تحقيق نتائج علاجية أفضل مع تقليل المضاعفات، خاصة في الأورام المعقدة أو القريبة من الأعضاء الحساسة.
ما هي مميزات العلاج بالبروتون؟
يمتاز العلاج بالبروتون بقدرته الفائقة على استهداف الورم بدقة عالية، مما يسمح بإيصال جرعة مركزة من الإشعاع إلى الخلايا السرطانية مع تقليل تعرض الأنسجة السليمة المحيطة. هذه الخاصية تقلل من شدة الأعراض الجانبية مقارنة بالعلاج الإشعاعي التقليدي، كما تخفض خطر الإصابة بأورام ثانوية ناجمة عن الإشعاع على المدى الطويل. من أبرز المميزات التي يوفرها هذا النوع من العلاج:
- حماية الوظائف العصبية الحيوية: مثل النطق والذاكرة عند معالجة أورام قريبة من مناطق حساسة في الدماغ.
- إمكانية إعادة العلاج: يمكن استخدامه بأمان في حال عودة الورم في نفس المنطقة التي تعرضت سابقاً للإشعاع.
- الحد من التعرض للأعضاء الحيوية: مثل القلب والرئتين في سرطانات الثدي أو العمود الفقري، مما يقلل من المضاعفات طويلة الأمد.
- أهمية خاصة لدى الأطفال: حيث يقلل من المخاطر المتأخرة المرتبطة بالعلاج الإشعاعي التقليدي، مثل تأخر النمو أو المشكلات الإدراكية.
- تقليل السمية وتحسين جودة الحياة: غالباً ما يتمكن المرضى من متابعة نشاطاتهم اليومية مثل العمل أو ممارسة الرياضة خلال فترة العلاج.
- دقة عالية في استهداف الأورام العميقة: بفضل تقنية المسح بالقلم التي تتيح تشكيل الجرعة بدقة ثلاثية الأبعاد لتتوافق مع شكل الورم.
- الفعالية في الأورام المقاومة للإشعاع التقليدي: مثل بعض الأورام العظمية والأورام القريبة من الأعصاب البصرية أو قاعدة الجمجمة.
إضافة إلى ذلك، فإن شعاع البروتون يتوقف عن التأثير بعد دخوله الورم ولا يترك جرعة “خروج” في الأنسجة بعده، ما يجعله أكثر أماناً خاصة عند علاج أورام قريبة من أعضاء بالغة الحساسية.
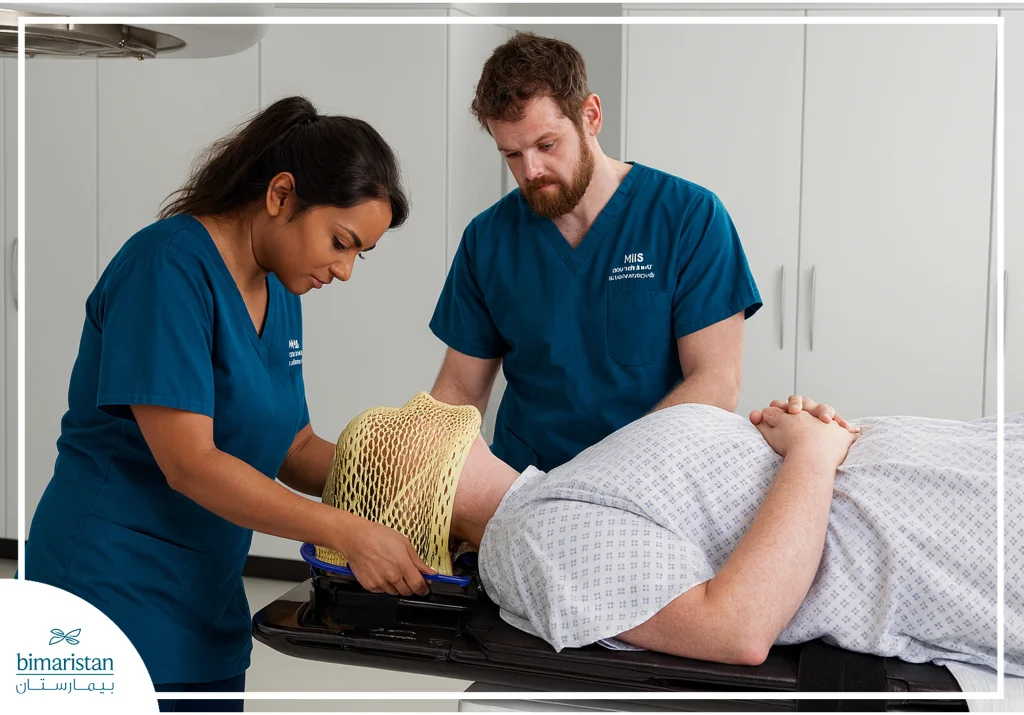
التحضير قبل العلاج بالبروتون
قبل بدء العلاج يخضع المريض لمرحلة تقييم شاملة تشمل مراجعة تاريخه الطبي وإجراء فحوص تصويرية مثل التصوير الطبقي المحوري (CT) والتصوير بالرنين المغناطيسي (MRI) والتصوير المقطعي بالإصدار البوزيتروني (PET)، وذلك لتحديد موقع الورم بدقة. بعدها يُصنع قالب تثبيت خاص مثل قناع للرأس أو قالب للجسم للحفاظ على الوضعية نفسها في كل جلسة.
يُجرى تصوير محاكاة خاص يُعرف بـ CT المحاكاة، وهو فحص طبقي محوري يُجرى في الوضعية نفسها التي سيتلقى فيها المريض العلاج، ويُستخدم لتحديد الورم بدقة وحماية الأعضاء الحساسة القريبة. غالباً تُدمج نتائجه مع فحوص أخرى مثل MRI أو PET للحصول على صورة أوضح. وتُعرف هذه المرحلة في المراكز العلاجية باسم مرحلة المحاكاة، لأنها تحاكي ظروف العلاج الحقيقية.
بعد ذلك يضع فريق العلاج خطة إشعاعية متكاملة باستخدام برامج متقدمة تحدد اتجاهات الحزم وتوزيع الجرعة على الورم مع تقليل الأثر على الأنسجة السليمة، وهي عملية دقيقة قد تستغرق عدة أسابيع قبل بدء العلاج.
خطوات إجراء العلاج بالبروتون
بعد اكتمال مرحلة التخطيط، يبدأ المريض جلساته العلاجية التي تُجرى عادةً خمس مرات أسبوعياً لعدة أسابيع، وقد يقتصر الأمر في بعض الحالات الخاصة على جلسة واحدة أو عدد محدود. لا يشعر المريض بمرور الإشعاع داخل جسده أثناء العلاج، لكنه قد يسمع أصوات الجهاز أثناء تشغيله. تتضمن الخطوات الأساسية للجلسة:
- تثبيت الوضعية: يُوضع المريض على طاولة العلاج باستخدام وسيلة تثبيت مخصصة مثل قناع للرأس أو قالب للجسم للحفاظ على الوضعية نفسها في كل جلسة.
- التحقق من الوضعية: تُجرى صورة سريعة (أشعة سينية أو طبقي محوري) للتأكد من أن الجسم في الوضعية الصحيحة كما خُطط لها مسبقاً.
- مغادرة الفريق الطبي: يخرج الفريق إلى غرفة التحكم لكنه يبقى على تواصل مرئي وسمعي مع المريض طوال الوقت.
- توجيه الشعاع: يتم توجيه جهاز الغانتري، وهو ذراع ميكانيكي ضخم قادر على الدوران 360 درجة، لتسديد شعاع البروتون نحو الورم من عدة زوايا وفق الخطة العلاجية.
- إعطاء الجرعة: يُسلط الشعاع لعدة دقائق، وقد يُعاد تشغيله وإيقافه أكثر من مرة تبعاً لحركة التنفس أو تغيّر موضع الورم.
- المتابعة المستمرة: يخضع المريض لفحوص دورية (عادةً تصوير طبقي محوري أسبوعي) للتأكد من دقة الجرعات وإعادة حسابها إذا تغير حجم الورم أو وزن المريض.
عادةً لا تتجاوز مدة العلاج الفعلية بضع دقائق، لكن التحضير والتموضع قد يستغرق من 30 إلى 45 دقيقة في كل موعد.
ما هي المخاطر والآثار الجانبية للعلاج بالبروتون؟
رغم المزايا العديدة التي يقدمها العلاج بالبروتون، إلا أنه لا يُعد الخيار الأنسب لجميع المرضى، حيث ترافقه بعض التحديات والمخاطر التي يجب أخذها بعين الاعتبار.
الآثار الجانبية المحتملة للعلاج بالبروتون
بما أن العلاج يستهدف الورم بدقة، فإن الأنسجة السليمة تتأثر بدرجة أقل مقارنة بالإشعاع التقليدي، لكن لا يخلو الأمر من بعض الأعراض التي تختلف باختلاف موضع الورم وجرعة العلاج، وتشمل:
- احمرار أو تهيج الجلد
- الشعور بالإرهاق والتعب العام
- تساقط الشعر في المنطقة المعالجة
- ألم أو انزعاج موضعي في مكان العلاج
سلبيات وتحديات العلاج بالبروتون
- محدودية التوفر: عدد مراكز العلاج بالبروتون حول العالم ما زال قليلاً، مما قد يضطر المريض إلى السفر لمسافات طويلة والخضوع لبرنامج علاجي قد يستمر عدة أسابيع.
- زمن التخطيط: يحتاج الأطباء لوقت أطول لوضع خطة علاجية دقيقة مقارنة بالعلاج الإشعاعي التقليدي، الأمر الذي قد لا يكون مناسباً في الحالات التي تستدعي بدء العلاج بسرعة.
- التكلفة والتغطية التأمينية: يعتبر العلاج بالبروتون أعلى تكلفة بسبب الأجهزة والبنية التحتية المعقدة، وفي بعض الحالات قد لا توافق شركات التأمين على تغطيته لغياب أدلة قطعية تؤكد تفوقه على الإشعاع التقليدي في جميع أنواع السرطان.
مدى فعالية العلاج بالبروتون وفق الدراسات
تشير الدراسات إلى أن العلاج بالبروتون يحقق نتائج علاجية مماثلة أو متفوقة على الإشعاع التقليدي مع تقليل ملحوظ في السمية. على سبيل المثال، أظهر تحليل سريري أن معدلات السيطرة الموضعية على الأورام في أورام قاعدة الجمجمة تجاوزت 80–90% بعد خمس سنوات، مع انخفاض واضح في الأعراض العصبية مقارنة بالفوتونات. وفي أورام الأطفال، بينت مراجعات أن استخدام البروتون خفّض المضاعفات المتأخرة بنسبة تصل إلى 40% مقارنة بالعلاج التقليدي، بما في ذلك مشاكل النمو والقدرات الإدراكية.
كما أظهرت دراسات أخرى أن المرضى الذين تلقوا العلاج بالبروتون لأورام الرأس والعنق عانوا من معدلات أقل لجفاف الفم وصعوبات البلع بنسبة تقارب 50% مقارنة بالإشعاع بالفوتونات، ورغم أن الدراسات العشوائية الكبيرة ما تزال محدودة، فإن هذه النتائج تدعم مكانة البروتون كخيار علاجي فعّال خاصة في الحالات الحساسة والمعقدة. ما زالت تستمر الأبحاث حالياً لتأكيد جدواه في سرطانات شائعة مثل الثدي والبروستاتا.
في الختام، يُعد العلاج بالبروتون من أبرز التقنيات الحديثة في علاج الأورام، حيث يتيح استهدافاً أدق للورم مع تقليل الأذى للأنسجة السليمة. أظهرت الدراسات فعاليته بشكل خاص في أورام الأطفال والأورام الحساسة، ما يجعله خياراً واعداً رغم محدودية توفره حالياً، ومع التقدم المستمر يُتوقع أن يحتل مكانة أكبر في أساليب علاج السرطان مستقبلاً.
المصادر:
- Liu, H., & Chang, J. Y. (2011). Proton therapy in clinical practice. Chinese journal of cancer, 30(5), 315–326. https://doi.org/10.5732/cjc.010.10529
- Bicer, B. (2023). Proton Therapy and Photon Radiation Therapy: A Clinical Review. Frontiers in Oncology, 13, 1133909. https://doi.org/10.3389/fonc.2023.1133909
- Mohan R. (2022). A Review of Proton Therapy – Current Status and Future Directions. Precision radiation oncology, 6(2), 164–176. https://doi.org/10.1002/pro6.1149
- Odei, B. C. L., Boothe, D., Keole, S. R., Vargas, C. E., Foote, R. L., Schild, S. E., & Ashman, J. B. (2017). A 20-Year Analysis of Clinical Trials Involving Proton Beam Therapy. International journal of particle therapy, 3(3), 398–406. https://doi.org/10.14338/IJPT-D-16-00030.1
- Johns Hopkins Medicine. (n.d.). Proton therapy. Johns Hopkins Medicine. https://www.hopkinsmedicine.org/health/treatment-tests-and-therapies/proton-therapy